(3)神経回路の形成・成熟・機能の研究のための方法論の開発
自らの疑問を解く技術が世の中になければ自ら開発することも必要です。また、すでに存在する技術を使う場合でも、多くの場合、そのまま使うよりも、少し時間をかけて自らの研究に最適化してから使うことによって、より効率的に研究を進めることができます。
私たちがこれまでに開発した方法論の例を下に挙げます。もちろん、すべて、多くの先人の研究成果の上に積み重ねたものであることはいうまでもありません。
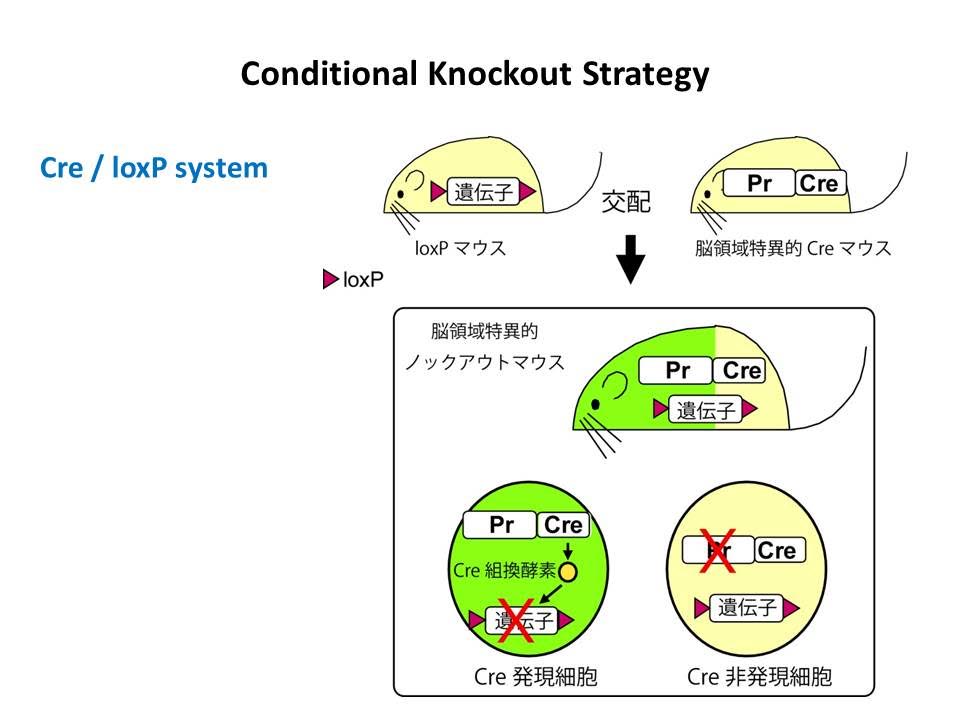
新しい遺伝子ノックアウトシステムの構築
大脳皮質の興奮性神経細胞特異的遺伝子ノックアウトシステムの構築
Iwasato et al., Nature 2000; Genesis 2004; J. Neurosci. 2008
ベースになる方法は、Cre/loxPを用いた条件的遺伝子ノックアウトです(上図)。しかしながら、この研究を始めた当時はCre/loxPを用いた脳領域特異的遺伝子ノックアウトの成功例は世界でも1例しかない時代であり技術的に多くの不確定要素がありました。、また、Creを発現させるためのプロモータに関する情報も非常に限られており、海図なしで大海原に乗り出したような気分でした。このマウスがはじめて手に入った時の興奮は今でも鮮明に覚えています。半信半疑で何度も実験を繰り返しましたが、何度やっても同様のきれいな結果がでて、はじめて安心しました。このマウスが手に入ったことによって、大脳皮質の神経回路発達に関する(私を含む多くの人達の)長年の疑問をクリアに解くことに成功し、論文はNature誌に掲載されました(Iwasato et al., 2000)。 しかし、その後の私たちの研究により、このマウスは当初の目的には完璧であったものの、目的によっては必ずしも十分でないことが徐々にわかってきました。2回にわたる根本的な改良(Iwasato et al.,Geneiss 2004, J. Neurosci. 2008)を経て最終的に完成したものは、現在でも大脳皮質研究(および興奮性と抑制性の研究)の標準的な方法として世界中の研究室で多くの研究に貢献しています。
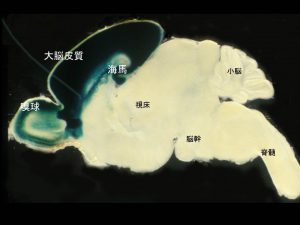
視床特異的遺伝子ノックアウトシステムの構築
Arakawa et al., J. Neurosci. 2014: Suzuki et al., Neurosci. 2015
大脳皮質の感覚野への入力は主に視床を経由して伝わります。したがって、大脳皮質構築メカニズムを知るためには、視床特異的遺伝子ノックアウトも必要となります。
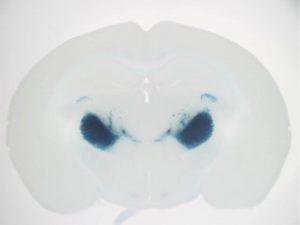
抑制性神経細胞特異的遺伝子ノックアウトシステムの構築
この頃になると、脳科学の発展によって、プロモータに関して膨大な情報が手に入る時代になっており、また、自分自身の経験値が上がったことにより、目的のマウスを計画的に作ることができるようになりました。地図のある海を航海するようなものです。とはいっても、一定の技術と経験は必要です。 Ogiwara et al., Hum. Mol. Genet. 2013
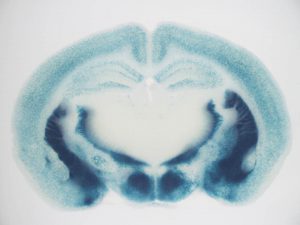
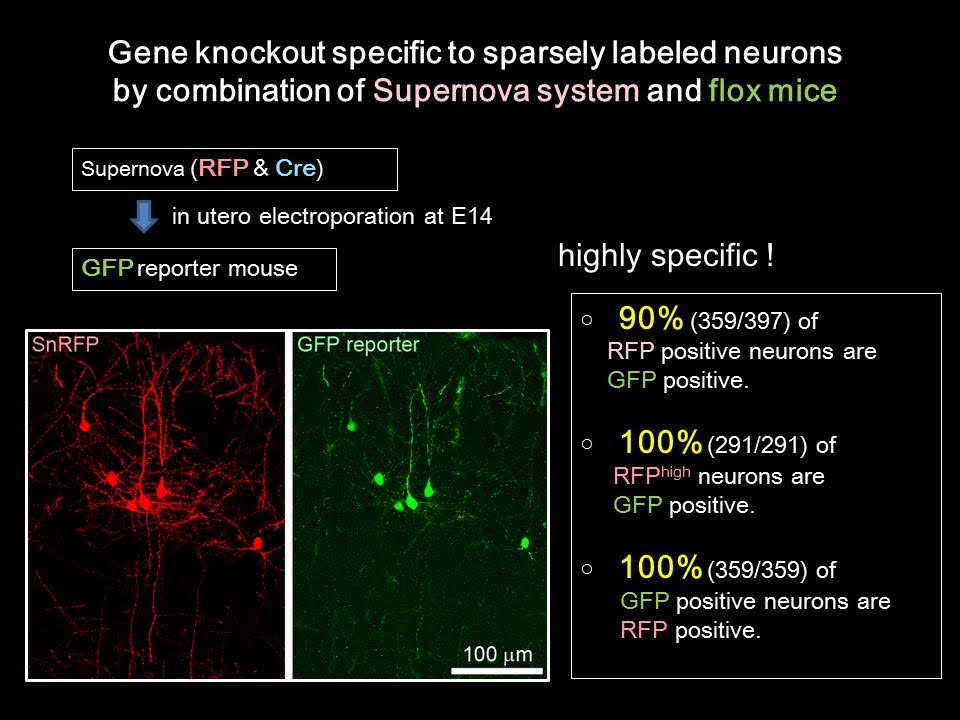
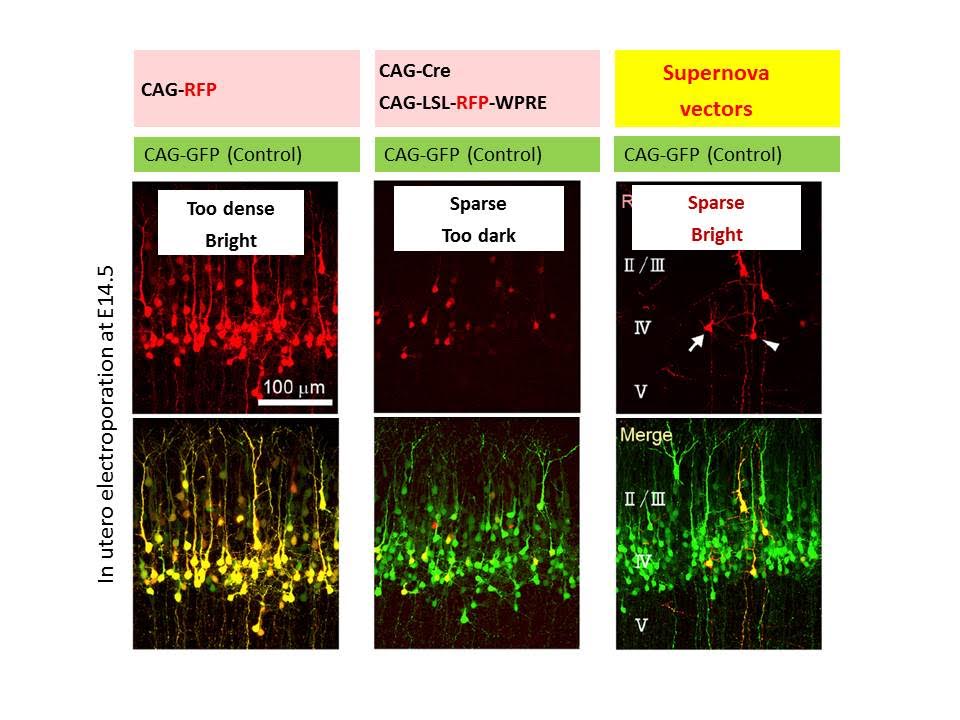
単一細胞特異的遺伝子ノックアウトシステムの構築(Supernova system)
Luo, Mizuno et al., Sci. Rep. 2016 資料
Mizuno,Luo et al., Neuron 2014 資料
この方法は、大脳皮質の1個の神経細胞でだけ神経活動を操作するために、助教の水野さんと大学院生の羅さんが中心となって開発したものです。次に述べるSupernova法を用いることによって、大脳皮質のまばらな細胞でのみCre組み換え酵素を強く発現させることができます。Floxマウスと組み合わせることによって、蛍光標識した細胞特異的に遺伝子をノックアウトすることができます。アイデアとしてはシンプルですが、水野さんと羅さんたちの注意深い実験と条件検討の繰り返しによって、効率のよいシステムを構築することに成功しました。できたてほやほやのシステムですが、ぜひ多くの人達に使っていただきたいと思います。
新しい神経回路標識法の開発
単一細胞の標識法の構築(Supernova system)Luo, Mizuno et al., Sci. Rep. 2016 資料
Mizuno, Luo et al., Neuron 2014 資料
生きているマウスの脳の中で神経回路(樹状突起や軸索)をクリアに観察するためには、神経細胞をまばらに明るく蛍光標識することが必要です。多くの人達が試みていますが、私たちの目的に適した方法は見つかりませんでした。したがって、自分たちで開発しました。いろいろなアイデアを試しましたが、tTA/TREのTetOFFシステムとCre/loxPシステムの組み合わせがとてもきれいに動きました。一部の細胞でのみtTA/TREで発現増幅することにより、これまでにない(当社比)明るい標識を達成しました。子宮内電気穿孔法を適用できるので、簡便で応用がききます。多くの目的に使えると思いますので、ぜひ使ってみてください。
 視床皮質軸索を蛍光標識するマウスの開発
視床皮質軸索を蛍光標識するマウスの開発Mizuno et al., Neuron 2014
生きたマウスで大脳皮質の神経回路構築の様子を観察するためには、視床皮質軸索を蛍光標識することが有効です。上で述べた視床特異的遺伝子ノックアウトシステム(すなわち、視床特異的Creマウス)の開発の過程で同定したプロモータを利用して、GFPを視床皮質軸索に発現させました。非常に明るいマウスが手に入りました。

新しいイメージング法の開発
新生仔マウス大脳皮質の長時間in vivoイメージング法の開発
Mizuno et al., Neuron 2014
生後5日目という幼いマウスの脳(大脳皮質)の中を18時間という長時間にわたってin vivoイメージングする試みは世界初です。助教の水野さんが中心となり、細かい工夫を積み重ねることにより達成しました。現在は、大学院生の中沢君がさらにその先を行くプロジェクトに取り組んでおり、非常に期待できる結果が出始めています。